一品红药业股份有限公司(股票代码∶300723,简称“一品红”)2024 年 4 月 8 日公告表示,一品红控股子公司广州瑞安博医药科技有限公司与博济医药科技股份有限公司于 2024 年 4 月 3 日签订了《技术服务(委托)合同》。合同约定广州瑞安博委托博济医药组织开展“AR882 胶囊”治疗原发性痛风伴高尿酸血症患者的 Ⅱ/Ⅲ 期临床试验研究服务。
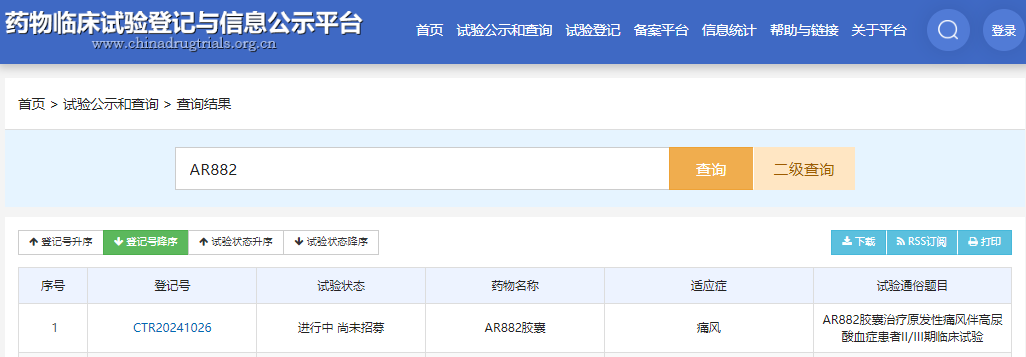
药物临床试验登记与信息公示平台截图
本次临床研究已于 2024 年 4 月 2 日在药物临床试验登记与信息公示平台登记,并获得中国医学科学院北京协和医院药物临床试验伦理委员会同意。本次临床研究计划中,临床 2 期试验为 AR882 和 非布司他 的头对头疗效试验,试验周期与全球临床 2 期试验同为 12 周;后续临床 3 期试验为期 28/30 周。本次临床研究由中国医学科学院北京协和医院曾小峰主任医师牵头,在全国 27 个城市 30 家医院开展,共需招募 636 位患者参与研究。
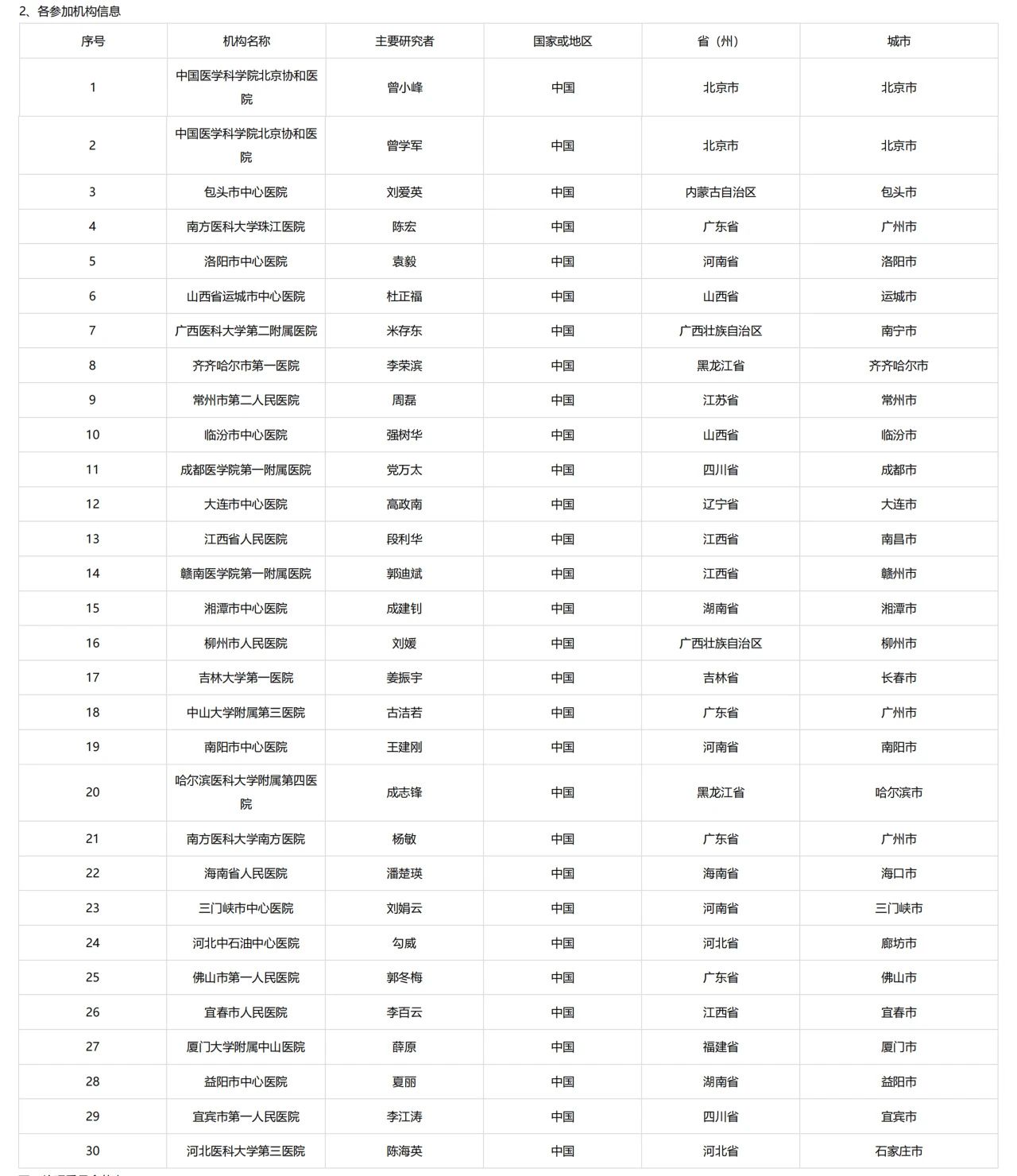
临床中心:全国27个城市30家医院
AR882 是 Arthrosi Therapeutics, Inc. 和一品红合作开发的一种高效选择性尿酸转运蛋白(URAT1)抑制剂,旨在通过抑制 URAT1 使尿液尿酸盐排泄正常化,从而降低血清尿酸(sUA)水平。AR882 克服了雷西纳德和苯溴马隆的缺点,能够与尿酸转运蛋白长效结合,延长抑制作用的时间,临床结果显示其药效长达 24 小时。而且,全天候的阻断尿酸重吸收不会加重肾负荷,可以避免肾毒性, 并有效清除体内尿酸,达到溶解痛风石的目的。
2023 年 1 月,美国 Arthrosi 公司欣然宣布,其用于治疗慢性痛风的 AR882 全球 2b 期临床试验取得了积极的顶线结果,这为 AR882 进入全球临床 3 期提供了坚实的基础。同年 8 月,Arthrosi 与美国食品药品监督管理局(“FDA”)EOP2 会议沟通完毕,FDA 书面反馈支持 Arthrosi 在研药物 AR882 按计划推进全球 3 期临床试验。同年 11 月,Arthrosi 将 AR882 溶解痛风石最新临床成果(治疗痛风石患者的 2 期临床研究成果)在 ACR 2023 年会上发布。该临床结果显示,与现有疗法相比,AR882 治疗痛风患者的疗效更好,安全性更高。AR882 除了能降低痛风患者的血清尿酸(sUA)水平,还能显著减少痛风石、减轻尿酸结晶负担及降低痛风急性发作率。
长融资本投资总监黄益德表示,“基于之前 AR882 全球临床试验数据推测,未来中国临床 2 期试验数据的展示,将大大提升其成为国内治疗痛风一线用药的概率。本次临床 2/3 期同时获批,也有望使后续的 3 期临床试验与 2 期实现快速对接,加速 AR882 药品上市的进程,势必对国内痛风市场的竞争格局产生巨大影响。挑战与机遇并存,我们拭目以待!”
关于Arthrosi Therapeutics
Arthrosi Therapeutics, Inc.成立于2018年,总部位于加利福尼亚州圣地亚哥。其目标是为痛风患者开发潜在的治疗方法,以调节尿酸水平并最小化关节损伤。Arthrosi的研究和开发已产生临床2b期完整数据。
